مقدمة بحث عن الاحماض والقواعد
بحث عن الاحماض والقواعد في الكيمياء فمما لاشك فيه ان الأحماض والقواعد تشكل قدر كبير في إحداث التفاعلات الكيميائية المهمة، حيث أن ملح الطعام ينتج عن حدوث تفاعل بين المركب الحمضي والمركب القاعدي، حيث أن معظم الأطعمة تشتمل على ما يعرف بالحموض وخصوصاً الحمضيات التي تحتوي على حمض الستريك والتفاح الذي يحتوي على حمض الماليك، وبالنسبة للبن فهو يحتوي على حمض اللاكتيك، أنا بالنسبة للقواعد فيتم استخدامها بشكل واسع، بالإضافة إلى استخدامه في صناعة الأسمدة الزراعية.
الحمض
الحمض عبارة عن مركب كيميائي، يشتمل على سلسلة عناصر الهيدرونيوم، والتي من الممكن أن يتم أخذه من عدة مصادر متنوعة، فمن الممكن أن تكون هذه العناصر نباتية أو حيوانية أو قد تكون من أصل معدني، حيث أن النوعين الأوليين يشكلان أهمية كبيرة لصحة الإنسان، أما بالنسبة للأحماض المعدنية فهي تكون سامة أو قد تسبب حروق للجلد.
ويوجد نوعان من الأحماض تم تصنيفهم على حسب مدى قوتهم، وتنقسم الأحماض من حيث القوة إلى أحماض قوية وأحماض ضعيفة، وهذا التصنيف يتم بناءاً على درجة تأين الحمض في الماء، ويُقاس قوة الأيونات بمدى درجة تفككها في الماء، فكلما تفككت أكثر في الماء، كلما أصبحت أكثر قوة.
*اقرا ايضا بحث عن اجتياز المقابلة الشخصية
مثال على الأحماض
- حمض الكبريتيك، ويتم استخدامه في صناعة بطاريات السيارات، بالإضافة إلى أنه يدخل في صناعة الأسمدة الزراعية.
- حمض الخل، ويشتمل هذا الحمض على نوعين، فالأول طبيعي حيث ينتج عن تخمر النباتات كالتفاح أو العنب، والآخر صناعي ويُستخدم في صناعة محلول الخل الصناعي.
- حمض الهيدروكلوريك، وهو الحمض الذي تقوم المعدة بإنتاجه للقيام بعملية هضم الطعام.
خواص محاليل الأحماض
تتمتع المحاليل الحمضية بمميزات كثيرة ومنها
- تعتبر المحاليل الحمضية من المحاليل الموصلة للتيار الكهربائي، وهناك علاقة طردية بين قوة الحمض ومدى قابليته لتوصيل الكهرباء، بمعنى أنه كلما كانت درجة الحمض قوية، كلما أصبح أكثر قابلية التوصيل للكهرباء.
- المحاليل الحمضية يحدث لها تغير في لونها مع الكواشف، مثل الميثيل الفينولفثالين، ومن ثم يتم التعرف على نوع المحلول إذا كان حمضياً أن لا بشكل سهل وذلك من خلال حدوث تغيير في لون.
- تفاعل المحاليل الحمضية مع الفلزات بطريقة قوية، ومن ثم يترتب عليها صعود غاز الهيدروچين.
القواعد
القواعد هي عبارة عن مركب كيميائي يشتمل على مجموعة الهيدروكسيد، في القواعد يكون لها شهرة واستخدامات متعددة، في القواعد توضع في الماء ويتم خلطهما معاً لإنتاج محلول قاعدي، ويوجد اختلاف بين قوة هذا المحلول مع اختلاف عدد الأيونات التي يتم تحليلها من المحلول القاعدي في الماء، ويكون المحلول قوي إذا رادت مجموعة الهيدروكسيد في الماء.
أمثلة على القواعد
١)هيدروكسيد الصوديوم، ويتم استخدامه في صناعة الصابون.
٢)هيدروكسيد الكالسيوم، ويتم استخدامه في البناء.
٣)هيدروكسيد الماغنسيوم، وهو يدخل في صناعة الأدوية التي تقوم بعلاج الحموضة.
خواص محاليل القواعد
يوجد المحاليل القاعدية مميزات متعددة.. وهي
١)تعتبر المحاليل القاعدية عامل جيد لتوصيل الكهرباء، وكلما زادت قابليتها للتوصيل إلى الكهرباء، كلما ازدادت عدد الأيونات المتحللة في الماء.
٢)الأيونات يُحدث لها تغير في اللون بعدما يتم إضافة المحاليل الكاشفة.
٣)ويُعتبر تفاعل الأحماض مع القلويات من أكثر التفاعلات الكيميائية الشهيرة؛ حيث يُنتج عن هذا التفاعل الملح والماء، وذلك بعد القيام بتبديل أيون الهيدروچين في الحمض موجب.
ومن أهم الأملاح الناتجة عن اتحاد الحمض وهو حمض الكلوريك مع القاعدة وهو هيدروكسيد الصوديوم هو ملح كلوريد الصوديوم، وهو المعروف بملح الطعام.
خصائص الأحماض
١)تقوم بتغيير ورق عباد الشمس إلى اللون الأحمر.
٢)الرقم الهيدروچيني الخاص بها يكون أقل من ٧.
٣)تأخذ الطعم الحمضي اللاذع.
٤)قابلة التوصيل للكهرباء، كما أنها تتحد مع القواعد.
٥) تقوم بإطلاق الهيدروچين في حالة تفاعله مع المعادن.
٦)عند القيام بوضع ورقة عباد الشمس في مادة حمضية، فإنه يتم تغيير لون الورقة من اللون الأزرق إلى الأحمر.
٧)عند وضع كاشف الفينولفثالين في الوسط الحمضي يصبح عديم اللون.
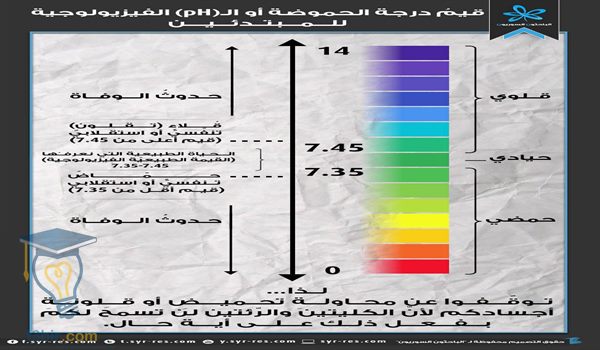
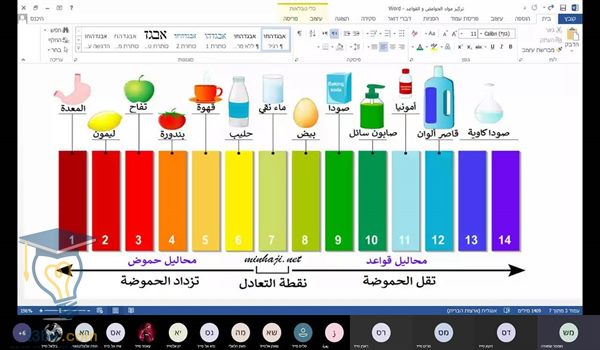
٨)الرقم الهيدروچيني للأحماض تكون أقل من سبعة، فكلما زادت نسبة الحمضية، كلما كان الرقم أقل، كما أنه يتم الإشارة لرقم الهيدروچيني بالرمز pH.
٩)كما أنه يُعرف بأن الرقم الهيدروچيني هو مؤشر لمعرفة نسبة الحموضة أو القلوية في المحلول، وفي حالة إذا كان الرقم الهيدروچيني متساوي مع الرقم ٧ فهذا يدل على أن المحلول متعادل، أما إذا كان الرقم الهيدروچيني أقل من ٧ فهو عبارة عن محلول حمضي، أما إذا كان أكبر من ٧ فيكون محلول قلوي.
١٠) الأحماض ذا طعم حمضي لاذع.
١١)موصل جيد للكهرباء.
١٢)الأحماض من شأنها تتمكن من تحييد القواعد، وأيضاً القواعد من شأنها تتمكن من تحييد الأحماض.
١٣)عند تفاعل القواعد مع الأحماض، فينتج عن هذا التفاعل التآكل، بالإضافة إلى تفاعل الأحماض مع القلويات فينتج عنهما الماء والملح.
١٤)عند اتحاد الأحماض مع المعادن، فينتج عن تفاعلهم غاز الهيدروچين مثل الألمنيوم والزنك والفلزات الأرضية القلوية والفلزات القلوية.
١٥) وبالنسبة لمفهوم الأحماض والقلويات عند أرهينيوس أنها تقوم بإنتاج أيونات +H في حالة ذوبانها في الماء.
١٦)من أهم الأمثلة التي تدل على الأحماض هي حمض النيتريك، حمض الهيدروكلوريك، حمض الهيدروبروميك، حمض الكبريتيك، حمض البيركلوريك، حمض الهيدرويد.
يتم تصنيف الأحماض إلى
حمض قوي وهو الذي يتم تحليله بشكل كلي في الماء مثل حمض الهيدروكلوريك HCL.
حمض ضعيف وهو الذي يتم تحليله بشكل جزئي في الماء مثل حمض الخليك.
خصائص القواعد
ذات طعم مر، كما أنها تكون كاوية حارقة.
قابلة للتوصيل للتيار الكهربائي.
تفاعلها مع الفلزات يكون أقل من الأحماض.
تتفاعل بشدة مع المواد الدهنية.
القواعد يتم تقسيمها إلى
قاعدة قوية وهي القاعدة التي يحدث لها تأين بشكل كلي في الماء، مثل هيدروكسيد الصوديوم Naoh.
قاعدة ضعيفة وهي القاعدة التي يحدث لها تأين بشكل جزئي في الماء مثل الأمونيا.
قوة الحمض والقاعدة
يتم تقسيم الأوساط الكيميائية الموجودة حولنا إلى ثلاثة أقسام وهما الوسط الحمضي، الوسط القاعدي القلوي، الوسط المتعادل وهو الذي يستخدم لوصف القاعدة والحمض في كثير من المجالات سواء كانت كيميائية أو حيوية، حيث تختلف قوة الأحماض والقلويات على حسب درجة تأينها في الماء.
بعض الملاحظات
كل الخصائص التي تم ذكرها، فهي تكون على علاقة طردية مع قوة الحمض، فهي تزداد مع زيادة قوة الحمض.
يتم استخدام التدريج العالمي المعروف من الصفر إلى الرقم ٧ لكي يدل على مدى قوة الحامض، ففي حالة إذا انخفض الرقم الهيدروچيني، فيحدث زيادة في قوة الحمض وذلك بسبب زيادة تركيز أيون الهيدرونيوم.
خاتمة بحث عن الاحماض والقواعد
نكون قد توصلنا إلى أن الأحماض ما هي إلا مواد تقوم بإطلاق أيون الهيدروچين، لينتج عنها مايُعرف أيون الهيدرونيوم.
وأن القواعد تقوم أيضاً بإطلاق أيون الهيدروچين لإنتاج ما يُعرف بمجموعة الهيدروكسيل،
والرقم الهيدروچينيPhيتم استخدامه لقياس قوة الحمض أو القاعدة وسط المحلول.
ثابت التأين للحمض وهو عبارة عن مقياس قدرة الحمض على تشكيل أيون الهيدرونيوم.
ثابت التأين للقاعدة وهو أيضاً عبارة عن مقياس لقيام القاعدة بتكوين أيون الهيدروكسيل.
وهذه الجمل تعتبر من أبرز المعلومات التي أردنا إيصالها ونتمنى أن نكون وضعنا أيدينا على النقاط الهامة.
وان كنت ترغب فى الحصول على بحث عن الاحماض والقواعد pdf ويكون جاهز للطباعه بالمصادر يرجى كتابه الاسم والايميل لكى نرسله لك على الايميل الخاص بك.